【JSTnews11月号掲載】イノベ見て歩き/大学発新産業創出基金事業 可能性検証(起業挑戦)「ポリグリセロール修飾炭化ホウ素ナノ粒子を用いた中性子捕捉療法によるがん治療」
炭化ホウ素ナノ粒子と中性子による新しいがん治療法
2025年11月21日 12時00分更新
社会実装につながる研究開発現場を紹介する「イノベ 見て歩き」。第25回は、がんの新しい治療法につながる研究に取り組む京都大学大学院人間・環境学研究科の小松直樹教授に話を聞いた。ホウ素を含むナノ粒子を使ってがん細胞だけを殺傷する技術を開発し、スタートアップを設立。すでにマウスでは効果を確かめており、ヒトでの臨床試験を目指している。
長時間点滴が必要なBNCT
患者への大きな負担が課題
京都大学の吉田南キャンパスにある小松直樹教授の研究室の棚に飾ってあるのは、サッカーボールやチューブのように見える模型。それぞれフラーレン、カーボンナノチューブと呼ばれるナノ材料で、炭素原子のみから構成されている。こうした炭素材料に興味を持って研究者人生を歩んできた小松さんが新たに取り組んでいるのが、ナノテクノロジーとホウ素中性子捕捉療法(BNCT)と呼ばれるがん治療法との融合だ。
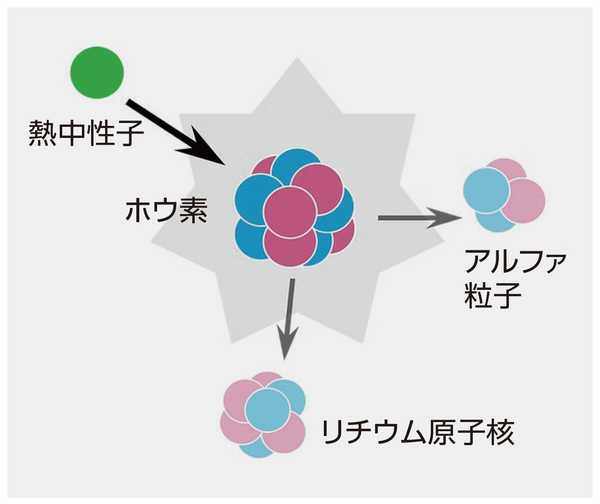
BNCT自体は既存の治療法である。生体に無害な熱中性子がホウ素に衝突すると核反応が起き、アルファ粒子とリチウム原子核が発生する(図1)。これらが、がん細胞のDNAを壊してがん細胞を殺傷するという仕組みだ。アルファ粒子とリチウム原子核の飛距離は細胞1個分にすぎないため、ホウ素をがん細胞のみに届けることができれば他の正常な細胞への影響は少ないと考えられている。
BNCTは2020年から一部のがんに対して保険適用となっているが、一方で課題もある。現行のBNCTでは、フェニルアラニンというアミノ酸にホウ素を結合させたボロノフェニルアラニン(BPA)が用いられている。がん細胞がフェニルアラニンを取り込みやすい性質を利用してホウ素をがん細胞に届ける。しかし、この薬剤は比較的小さな分子であり、腫瘍や血中での滞留性が悪く、さらに水溶性も低いという問題があるため、点滴を3時間も受けなければならず、患者の負担は大きい。また、正常な細胞もフェニルアラニンを取り込むため、ホウ素が正常な細胞にも蓄積するおそれがある。そのため、体内の奥深くにあるがん細胞に熱中性子を当てようとすると、正常な細胞も破壊してしまう懸念がある。こうした理由から現在のBNCTは、体の表面に近い鼻や喉などを含む頭頸(けい)部がんにのみ保険適用となっている。
新たな出会いが生んだ成果
新製剤なら注射1回で済む
小松さんがBNCTの研究を始めたのは2015年に京都大学に着任してからだ。それ以前は10年ほど滋賀医科大学で、ナノ材料をキャリアとして体内の狙った場所に薬剤を運ぶ「ドラッグデリバリーシステム(DDS)」の研究に取り組んでいた。
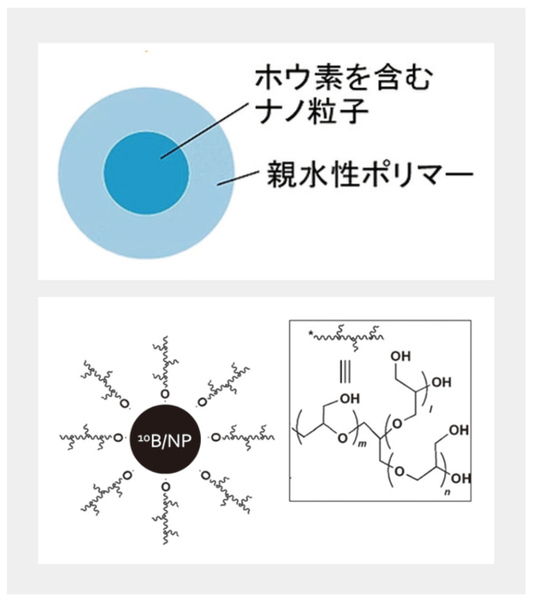
京都大学には複合原子力科学研究所という原子炉施設があり、長らくBNCTの研究開発が進められてきた。小松さんはDDS研究で扱ってきたナノダイヤモンド粒子中の炭素をホウ素に置き換えることで、大量のホウ素を効率良くがん細胞に運べるのではないかと考え、同研究所の鈴木実教授との共同研究を開始。ホウ素を豊富に含むナノ粒子を水に良く溶ける高分子(親水性ポリマー)で包んだ新しい製剤「RN-501」を開発した(図2)。これについて「鈴木さんと出会えたことにより生まれた成果です」と小松さんは振り返る。
研究を進める中で、京都大学の研究者の起業を支援する京都大学イノベーションキャピタル(京都iCAP)の上野博之さんから社会実装に向けたアドバイスを受ける。そこで、JSTの大学発新産業創出基金事業の可能性検証(起業挑戦)に応募し、社会実装に向けたがん再発抑止能や安全性などの検証を行うことにした。
小松さんらの技術は、現行のホウ素製剤(BPA)が1ナノメートルに満たない大きさの分子であるのに対し、50ナノメートルのナノ粒子を用いている点で大きく異なる。ナノ粒子はがん組織への滞留性に優れているため、薬剤の注入が注射1回で済む。注射して2日後には、マウスの腫瘍に十分な量のホウ素が蓄積していることも確認された。そこに熱中性子を当てると、3週間後には5匹中4匹のマウスで腫瘍が消失することがわかった(図3)。「現行のホウ素製剤に比べ、がん組織により多くのホウ素が長期にわたって滞留するのが大きな特徴です。この特徴を生かせば、体内の奥深くにあるがんも治療できるかもしれません」と話し、将来的には肺がんの治療を目指している。
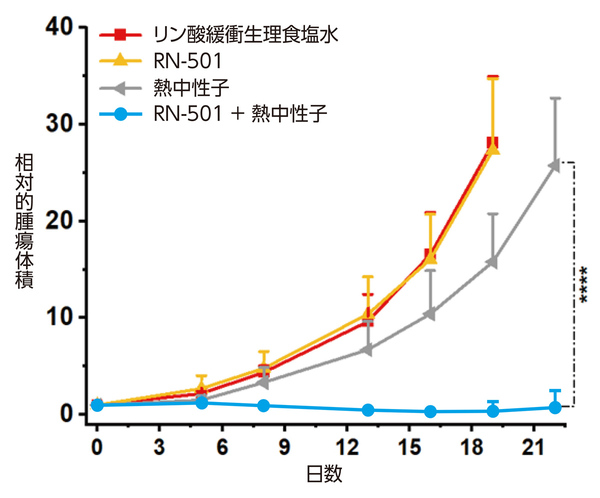
図3 マウスへの処置後経過日数と相対的腫瘍体積の変化。生理食塩水の注射(赤色)、RN-501の注射のみ(黄色)、熱中性子の照射のみ(灰色)の場合は腫瘍体積が大きくなったが、RN501を注射し熱中性子を照射(水色)したマウスは、5匹中4匹で腫瘍の消失が見られた。
また、RN-501を用いたBNCTによる治療は、すでにあるがんを殺傷するだけでなく、がんの再発予防効果があるかもしれないという。まず、マウスの太ももに腫瘍を移植した後、RN-501を用いたBNCTでがん治療を行う。次に、がんが治ったマウスのもう片方の太ももに腫瘍を再度移植したところ、移植したがんが全く生着しなかった。これは、免疫系ががん抗原を記憶した可能性を示しているという。「がん抗原を記憶した免疫系ががんの再発を抑止する、いわばがんワクチンと似たような作用があるかもしれません」と、小松さんは推測する。
選択性向上や可視化に取り組む
謎の「ワクチン効果」も解明へ
実験の結果から、RN-501を用いたBNCTで治験に向けた本格的な研究に踏み切ることができると判断。2024年4月に、ヒトでの臨床試験とその社会実装を目指すスタートアップ「RadioNano Therapeutics(ラジオナノセラピューティクス)」を、長年、大手製薬企業で勤務してきた千葉雅俊さん、川井洋さん、京都iCAPの上野さんと共に吉田キャンパス内に設立、鈴木さんは科学諮問委員、小松さんは社外取締役・科学諮問委員を務めている。「基礎研究を続けてきた人間なので私自身が起業することは考えていませんでしたが、自分の研究成果が社会実装されることは研究者冥利に尽きます」と話す。
同年11月、JSTは出資型新事業創出支援プログラム(SUCCESS)において同社に出資した。他社からの出資も併せ、がんへの選択性の向上や画像診断による可視化といった、RN-501の性能の向上や機能の追加に取り組んでいる。2025年4月には日本医療研究開発機構(AMED)の「橋渡し研究プログラム(シーズF)」に採択され、臨床試験の実施に向けた研究をさらに加速させようとしている。
小松さん自身は今後も粛々と基礎研究を続けたいと考えている。「実は、ナノ粒子はがん細胞の内部に取り込まれず、細胞外にいるのではないかということも示唆されています。ワクチンに似た作用なども含め、詳しい性質を解き明かしたいです」と、研究の展望を語る。小松さんの研究がこれからのがん治療の新たな選択肢になることを願いたい。

この連載の記事
-
第66回
TECH
あらゆる元素を扱う無機合成化学で新材料を創出し、社会問題の解決へ -
第65回
TECH
手術後の胆汁の漏れを防ぐ新たなハイドロゲルを開発 -
第64回
TECH
脳内の隙間細胞による、記憶を選んで残すメカニズム解明へ -
第63回
TECH
地磁気の約200万倍・110テスラの磁場を発生する、移動可能な小型磁場発生装置を開発 -
第62回
TECH
女王を中心とした分業制社会をつくるハダカデバネズミの行動を解明 -
第61回
TECH
量子ビームが生み出す新しい細胞培養用ゲル材料 -
第60回
TECH
海水の温度差を利用し発電する、持続可能な再生可能エネルギー -
第59回
TECH
脱炭素への道筋を論理的・定量的に提示する「社会シナリオ」とは? -
第58回
TECH
アンデス・アマゾン考古学で探る人と自然の共生システム -
第57回
TECH
「誰」を優先対象とすべきか、ポストコロナ時代の新型コロナワクチン接種 -
第56回
TECH
食虫植物が獲物を捕らえる「感覚毛」の全容解明に一歩前進 - この連載の一覧へ